PATCE
martes, 23 de abril de 2013
Princippia, Innovación Educativa: ¿Qué hacer con las páginas interesantes que encontramos en internet?. Una solución: DIIGO
EDUCCERE: reflexion y desarrollo: Aprender matemática
EDUCCERE: reflexion y desarrollo: Aprender matemática: Creo sin equivocarme que todos nosotros en algún momento del aprendizaje de la matemática experimentamos emociones que iban desde la tra...
sábado, 3 de diciembre de 2011
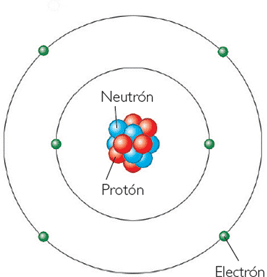
LABORATORIO
Con la ayuda de tu Tabla Periódica, y con las fórmulas de Número Atómico y Número
Másico.
I. ELIGE LA ALTERNATIVA CORRECTA
1.- Si Z es el número atómico de un átomo de un elemento y A es su número másico, entonces A – Z es su:
I) Número de neutrones.
II) Número de neutrones menos su número de protones.
III) Número de electrones.
A) Sólo I.
B) Sólo II.
C) Sólo III.
D) Sólo II y III.
E) Se requiere información adicional.
2.- El núcleo de un átomo consta de 6 protones y 8 neutrones, entonces:
A) Su número atómico es 8.
B) Su número másico es 8.
C) Su número atómico es 14.
D) Su número másico es 14.
E) Su número de electrones es 14.
3.- El (los) ión(es) que tiene(n) la misma configuración electrónica del Ne es (son):
I) O – 2
II) Na +
III) Mg + 2
A) Sólo I.
B) Sólo I y II.
C) Sólo I y III.
D) Sólo II y III.
E) I, II y III.
4.- ¿Cuál(es) de las siguientes afirmaciones con respecto al C 12 y C 14 es (son) verdadera(s)?:
I) Tienen igual número atómico Z.
II) Tienen igual número másico A.
III) Son isótopos.
A) Sólo I.
B) Sólo II.
C) Sólo III.
D) Sólo I y III.
E) I, II y III.
5.- ¿Cuál(es) de las siguientes afirmaciones con respecto al C 14 y N 14 es (son) verdadera(s)?:
I) Tienen igual número atómico Z.
II) Tienen igual número másico A.
III) Son isóbaros.
A) Sólo I.
B) Sólo II.
C) Sólo III.
D) Sólo I y II.
E) Sólo II y III.
II. Señala las afirmaciones correctas:
1. ___ El número másico de un átomo es la suma del número de protones, neutrones y electrones ¿POR QUÉ? __________________________________________
2. ___ Todos los átomos de un mismo elemento químico tienen el mismo número de neutrones ¿POR QUÉ? ___________________________________________
3. ___ Los isótopos de un elemento químico tienen el mismo número atómico ¿POR QUÉ? ________________________________________________________
4. ___ Los isótopos de un elemento químico tienen el mismo número másico ¿POR QUÉ? ________________________________________________________
5. ___ Los isótopos de un elemento químico tienen distinto número de neutrones ¿POR QUÉ? __________________________________________________
BIBLIOGRAFÍA
1. PHILLIPS, Tony «La Tierra en el Perihelio» (2001). Ciencia NASA
2. BUIS, Alan «Chilean Quake May Have Shortened Earth Days» (2010). NASA.
3. ARGUELLO, Luis (2003). «Mecánica». pág. 190.
4. LAMBECK, K., 1980, The Earth's Variable Rotation: Geophysical Causes and Consequences, Cambridge University Press, London
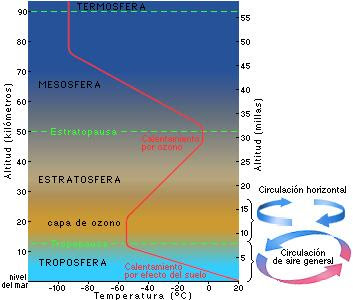
1) LABORATORIO
A lo largo de nuestro accionar vamos a mirar muchas veces a la atmósfera e intentar saber algo más sobre ella y sus efectos.
I. AHORA PIENSA y EXPLICA:
1. ¿Sabes por qué asciende un globo si lo sueltas?
2. ¿Sabes porque llevan fuego los globos aerostáticos?
3. ¿Por qué se mueve un barco de vela?
4. ¿Qué gases respiramos de esta atmósfera?
5. ¿Qué son las nubes?, ¿Son todas iguales?
6. ¿Es la atmósfera igual en toda su extensión? ¿Por qué?
7. ¿Sabes lo que es la capa de ozono? ¿Para qué es importante?
II. MENTES EN ACCIÓN
a) Menciona al menos tres acciones que veas realizar en casa o en el barrio todos los días y que produzca contaminación atmosférica.
b) Menciona cinco medidas en las cuales intervengas tú como integrante del planeta Tierra, para evitar la contaminación de nuestro ambiente.
2)LABORATORIO
COMPROBANDO LOS GASES EN LA ATMÓSFERA
Tener en cuenta: Los gases en el aire son vitales para la vida en la Tierra. El oxígeno es necesario para la respiración, y es un elemento del agua. El anhídrido carbónico es necesario para la fotosíntesis. El oxígeno también es esencial para los procesos de oxidación, tales como la corrosión (formación de óxido) y la combustión (quema). Para ver una función importante del oxígeno, prueba esta demostración.
Objetivo: Comprobando los diversos gases existentes en la atmósfera, mediante el uso de la llama. Y relacionarlo con lo útil que es para los seres vivos.
¿Cómo comprobar cuan útil es el aire en la vida de los seres vivos?
Hipótesis
______________________________________________________________________________________________________________________________________
ADVERTENCIA: ESTA ACTIVIDAD IMPLICA El USO DE FOSFOROS. SE REQUIERE REALIZARLO EN EL LABORATORIO CON LA SUPERVISIÓN DE TU PROFESORA DE CIENCIAS.
Materiales necesarios:
• Una vela pequeña de aproximadamente 8 cm. de altura
• Fósforos o un encendedor
• Un frasco de vidrio transparente con una capacidad de aproximadamente 1 l.
• Una cacerola plana, similar a las que se utilizan para pasteles, llena con aproximadamente 0.5 mm. de agua.
Procedimiento
1. Enciende la vela y deja gotear suficiente cera como para formar un charco de cera del tamaño de una moneda de veinticinco centavos en el centro de la cacerola.
2. Presiona la parte inferior de la vela en la cera y déjala enfriar. Esto mantendrá la vela en posición vertical.
3. Vierte el agua en la cacerola plana.
4. Coloca el frasco sobre la vela encendida - el agua servirá para sellar los bordes del frasco.
5. Observa cuidadosamente la llama.
DISCUSIÓN
• ¿Qué sucedió con la llama?
__________________________________________________________________________________________________________________________
• ¿Cuáles podrían ser algunas de las razones por las que esto sucedió?
__________________________________________________________________________________________________________________________
• ¿Qué sucedió con el agua?
__________________________________________________________________________________________________________________________
• ¿Por qué sucedió esto?
__________________________________________________________________________________________________________________________
• ¿Podrías diseñar un experimento para probar los efectos de la falta de aire en las plantas, en los animales y en el ser humano? ¿Cuáles crees que serían los resultados?
__________________________________________________________________________________________________________________________
• ¿Qué medidas crees que deberíamos tener en cuenta para evitar contaminar nuestra atmósfera? Por qué
__________________________________________________________________________________________________________________________
CONCLUSIONES
Revisa la hipótesis planteada compara los resultados y escribe tus conclusiones
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
BIBLIOGRAFÍA
1. PHILLIPS, Tony «La Tierra en el Perihelio» (2001). Ciencia NASA
2. BUIS, Alan «Chilean Quake May Have Shortened Earth Days» (2010). NASA.
3. ARGUELLO, Luis (2003). «Mecánica». pág. 190.
4. LAMBECK, K., 1980, The Earth's Variable Rotation: Geophysical Causes and Consequences, Cambridge University Press, London

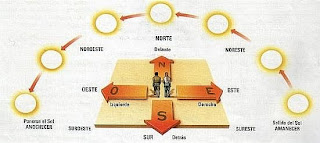
LABORATORIO
I. OBSERVA Y ARGUMENTA TU RESPUESTA
1. Fíjate en el dibujo cómo se va levantando el Sol desde el amanecer hasta el mediodía y luego hasta el anochecer:
a. ¿En cuál de estas posiciones el Sol proporciona mayor calor? ¿Por qué?
b. ¿En cuáles de estas posiciones el Sol proporciona menos calor? ¿Por qué?
c. ¿Por qué el Sol sale por el Este y se pone por el Oeste?
d. ¿Dónde se sitúan los puntos cardinales simples y compuestos en un mapa?
2. Con ayuda de un globo terráqueo, descubre:
a) Un país donde esté amaneciendo cuando en España está anocheciendo. ¿Por qué?
b) Un país donde sea mediodía cuando en España está amaneciendo. ¿Por qué?
c) Un país donde sea mediodía cuando en España está anocheciendo. ¿Por qué?
II. RESPONDE Y FUNDAMENTA
a) En relación con el movimiento de traslación de la Tierra y la inclinación de su eje de rotación, explica ¿porqué en algunas zonas de nuestro planeta se diferencian tanto las estaciones y en otras apenas hay cambios?
b) ¿Por qué las estaciones tienen lugar en épocas contrarias del año en los Hemisferios Norte y Sur? ¿Por qué son los días invernales más cortos y fríos en el Hemisferio Norte? ¿Cómo serán en el Hemisferio Sur durante el mes de julio?
c) ¿Qué cambios ocurrirían en nuestro país si el eje de rotación de la Tierra fuera perpendicular al plano de su órbita alrededor del Sol? Argumenta.
d) ¿Por qué hay años bisiestos? ¿Cada cuanto tiempo se establecen?
III. OBSERVA Y RESPONDE
Son la 12, hora solar, en Barcelona. ¿Qué hora solar es en Roma, El Cairo, Tokio, Buenos Aires, México y Los Ángeles?
¿Por qué varía las horas en estas ciudades?
…………………………………………………………………………………………………………………………………………………………………………

LABORATORIO
I. ELIGE UN LETRA COMO ALTERNATIVA CORRECTA
1. EL PLANETA JUPITER TIENE LA SIGUIENTE CARACTERÍSTICA.
a) Sobresale la Gran Mancha Roja que realiza un flujo turbulento
b) Tiene un satélite llamada Caronte, que es casi de su mismo tamaño,
c) En el interior de Urano no es propicio para la vida, ya que la presión y el frío son extremos
¿Por qué?
d) Realizan movimientos que se asemeja a un inmenso ciclón y es de forma de espiral.
e) Es menos denso; más ligero
f) Los rayos del Sol no traspasan poco más de unos cientos de metros la atmósfera.
La alternativa correcta es:
A) a,d
B) b,e
C) c,f
D) a,e
2.EL PLANETA VENUS ES MÁS DENSO POR :
a) La capa de nubes de dióxido de carbono.
b) Una atmósfera densa con oxígeno, Se destaca por el color azul de los océanos y el blanco de las nubes en su atmósfera.
c) Una atmósfera tenue.
¿Por qué?
d) Son condiciones imprescindibles para el desarrollo de la vida.
e) Hecho de rocas y hielo.
f) Produce un efecto invernadero extremo
La alternativa correcta es:
A) a,f
B) b,d
C) c,e
D) c,a
3.LOS PLANETAS URANO Y NEPTUNO LLAMADOS GIGANTES GASEOSOS
a) Por tener gran actividad en su atmósfera
b) Conjunto de sustancias donde existe entre sus moléculas poca fuerza de atracción
c) Su superficie es rica en hierro
¿Por qué?
d) Sus océanos y el blanco de la nube de su atmósfera
e) Tener 100.000pequeños anillos girando entorno a ellos.
f) Contiene en su atmósfera el gas metano, hidrógeno y helio
La alternativa correcta es:
A) a,d
B) c,e
C) b,f
D) a,f
II. LLENA CORRECTAMENTE EN LOS ESPACIO PUNTEADOS:
Son características de los:
a) ……………………….. son cuerpos celestes de forma irregulares, frágiles y pequeños POR QUÉ está compuesto de: ………………………………………………………………
b) Los asteroides son objetos …………………………no son considerados planetas PORQUE……………………………….,
c) El……….es una estrella, es la principal fuente de energía, PORQUE…………………………………………………………
d) En el planeta……………….. hace más calor PORQUE……………………………………. Y su temperatura máxima es de…………
REFERENCIAS BIBLIOGRÁFICAS
1. PHILLIPS, Tony «La Tierra en el Perihelio» (2001). Ciencia NASA
2. BUIS, Alan «Chilean Quake May Have Shortened Earth Days» (2010). NASA.
3. ARGUELLO, Luis (2003). «Mecánica». pág. 190.
4. LAMBECK, K., 1980, The Earth's Variable Rotation: Geophysical Causes and Consequences, Cambridge University Press, London
martes, 18 de octubre de 2011



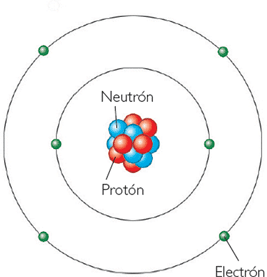
ESTRUCTURA DEL ÁTOMO (04)
El átomo como un sistema energético en equilibrio, está constituido por una parte central donde prácticamente se concentra toda su masa, llamada núcleo que contiene a los protones y neutrones y una región de espacio exterior que es la nube electrónica donde se hallan los electrones ubicados en regiones de máxima probabilidad; reempes u orbitales.
NÚCLE ATÓMICO El núcleo es la parte central del átomo y contiene partículas con carga positiva, los protones, y partículas que no poseen carga eléctrica, es decir son neutras, los neutrones.
La masa de un protón es aproximadamente igual a la de un neutrón.
En el núcleo se encuentra concentrada la carga positiva representada por los protones.
Propiedades del Núcleo
1.- Número Atómico: Es el número de protones libres que hay en el núcleo de cada átomo y se representa por la letra mayúscula “Z”; de donde:
Z = p+
Cuando el átomo es neutro, el número de protones es igual al número de electrones que hay en la zona cortical de cada átomo, en este caso se cumple que:
Z = p+ = e-
Es muy importante saber que cada elemento de la Tabla Periódica tiene su número atómico propio, inconfundible y característico él cual representa:
El número de protones en el núcleo
El número de electrones en la envoltura
El número de orden del elemento en la Tabla Periódica.
2.- NÚMERO MÁSICO O NÚMERO DE MASA.
Es igual a la suma de los protones más los neutrones, que hay en el núcleo, se representa por la letra “A”; si el átomo es neutro también resulta igual a la suma de electrones y neutrones.
Reemplazando p+ por Z en la fórmula anterior, obtenemos la siguiente fórmula importante:
A = no + Z
En la fórmula despejamos no, obtenemos la siguiente fórmula que nos permite calcular el número de neutrones.
3.- Representación del Núcleo.- El núcleo de un átomo se representa por tres datos fundamentales, símbolo, número atómico y el número de masa. La representación general para cualquier núcleo es:
X o ZX
Donde:
A = número de masa
X = Símbolo del elemento
Z = número de protones
Ejemplo: Representa el núcleo del elemento 13 y determina el número de protones, electrones u neutrones. Además su número de masa es 27.
Datos:
p+ = 13 no = A – p+
no= no = 27 – 13
e-= 13
no = 14
Z = 13
A= 27
4.- Los Isótopos son átomos de un mismo elemento que tienen igual número de protones y electrones (igual número atómico) pero diferente número de neutrones (difieren en su masa atómica).
Por ejemplo el Hidrógeno tiene 3 isótopos : el Protio , el deuterio y el tritio.
Protio Deuterio Tritio
1 2 3
H H H
1 1 1
Los 3 isótopos tienen un protón y un electrón, pero el protio no posee neutrones, el deuterio tiene 1 neutrón y el tritio tiene 2 neutrones.
Obviamente el átomo más pesado es el tritio (masa=3 uma), pero también es el más inestable y por tanto el menos abundante.
Por ejemplo
El carbono tiene 3 isótopos diferentes, el C-12, el C-13 y el C-14, de los cuales el C-14 sólo se encuentra en trazas .Prácticamente la masa atómica representada en la tabla periódica se calcula de los isótopos C-12 y C-13.
En la tabla periódica se tiene en la casilla del carbono, un átomo con Z = 6 y M = 12.01115, como se observa a continuación.
12.01115
6C
Carbono
Los isótopos más abundantes del Carbono tienen ambos 6 protones y 6 electrones, pero diferente número de neutrones, 7 y 6 respectivamente:
13 12
C C
6 6
5.- Isótonos
Átomos que presentan distinto número de masa, distinto número atómico, pero tienen igual número de neutrones.
Ejemplo:
Tienen en común el mismo número de neutrones que es 6.
37 40
Cl, Ca
17 20
6.- Isóbaros.-
Son átomos de diferentes elementos químicos, por lo tanto, tienen DIFERENTE n° atómico y n° de neutrones, pero cuentan con el MISMO número de masa. Sus propiedades químicas son diferentes.
Ejemplo: 39 40
K Ca
19 20
7.- Radioactividad.-
Es un fenómeno de desintegración nuclear, que consiste en la emisión espontánea de radiaciones alfa, beta o gamma, y por la que durante un proceso un elemento se transforma en otro.
Suscribirse a:
Entradas (Atom)